การศึกษากลไกของการยับยั้งการทำงานของยีนที่เกี่ยวข้องกับการแบ่งเซลล์แบบไมโทซีสในเซลล์มะเร็งท่อน้ำดี


โรคมะเร็งท่อน้ำดี เป็นมะเร็งที่เกิดขึ้นกับเซลล์เยื่อบุผนังของทางเดินท่อน้ำดี ซึ่งเป็นอวัยวะที่นำน้ำดีจากตับมายังลำไส้เล็ก อุบัติการณ์ของโรคมะเร็งท่อน้ำดีทั้งชนิดภายในตับ และภายนอกตับ พบมากในประเทศแถบเอเชียโดยเฉพาะอย่างยิ่งภาคตะวันออกเฉียงเหนือของประเทศไทย ปัจจัยเสี่ยงและสาเหตุหลักของการเกิดมะเร็งท่อน้ำดีเกิดจากการอักเสบของเซลล์ท่อน้ำดี และการติดเชื้อพยาธิใบไม้ในตับ การรักษาอาการของโรคมีข้อจำกัดเนื่องจากการแสดงออกของโรคมักเกิดขึ้นเมื่อโรคมีการพัฒนาไปสู่ระยะลุกลามแล้ว
โรคมะเร็งเกิดจากความผิดปกติและการกลายพันธ์ของยีน ส่งผลให้เกิดการพัฒนาของเซลล์ไปเป็นเซลล์มะเร็งซึ่งมีการควบคุมการแบ่งตัวของเซลล์ที่ผิดปกติ ในปัจจุบันความรู้ความเข้าใจเกี่ยวกับกลไกที่เกิดขึ้นในเซลล์มะเร็งท่อน้ำดี และการค้นหาตัวบ่งชี้ต่อการตอบสนองต่อการยับยั้งการเจริญของเซลล์มะเร็งซึ่งจะมีบทบาทสำคัญต่อการพัฒนาการรักษาโรคมะเร็งท่อน้ำดียังมีไม่เพียงพอ
จากงานวิจัยของสถาบันวิจัยจุฬาภรณ์ที่ผ่านมา (Chaisaingmongkol et al., 2017) พบว่า ยีนที่ควบคุมการแบ่งตัวของเซลล์แบบไมโทซีสมีการแสดงออกที่เพิ่มขึ้นในเซลล์มะเร็งท่อน้ำดี งานวิจัยต่อยอดนี้ มีจุดประสงค์ที่จะศึกษากลไกที่เกิดขึ้นหลังจากการยับยั้งยีนที่เกี่ยวข้องกับการแบ่งเซลล์แบบไมโทซีสในเซลล์มะเร็งท่อน้ำดีเพาะเลี้ยงหลายชนิดที่แตกต่างกัน เพื่อหาตัวบ่งชี้ต่อการตอบสนองการยับยั้งยีนดังกล่าว งานวิจัยนี้จะสร้างองค์ความรู้ที่เข้าใจกลไกของการตอบสนองต่อการยับยั้งการทำงานของยีนที่เกี่ยวข้องกับการแบ่งเซลล์ และการเปลี่ยนแปลงทางชีวโมเลกุลที่สำคัญ ซึ่งจะสามารถนำผลงานวิจัยไปต่อยอดในการพัฒนาแนวทางรักษาโรคมะเร็งท่อน้ำดีและเข้าใจตัวบ่งชี้ต่อการตอบสนองในการรักษาโรคมะเร็งท่อน้ำดีได้
Schematic diagram of Polo-like kinase (PLK)1 regulation og the cell cycle
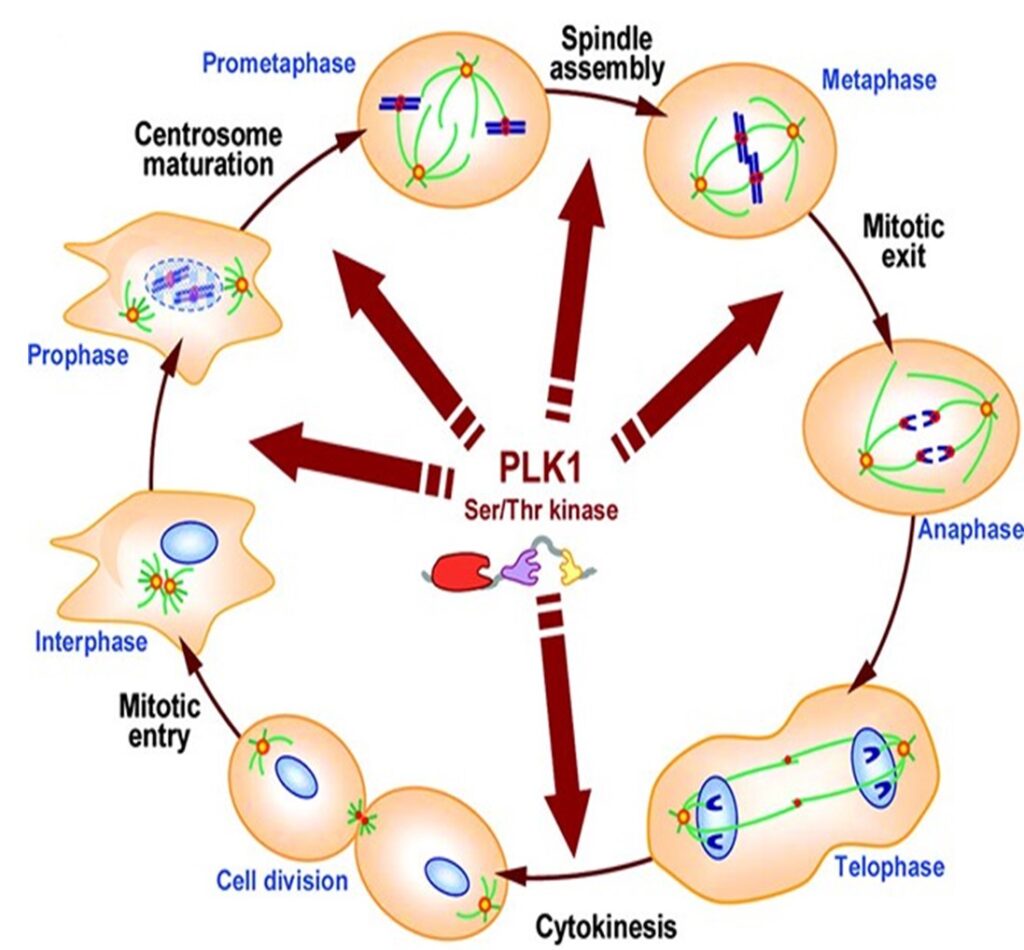 Oncologist, Volume 14, Issue 6, June 2009, Pages 559–570
Oncologist, Volume 14, Issue 6, June 2009, Pages 559–570
เอกสารอ้างอิง
Chaisaingmongkol, J., Budhu, A., Dang, H., Rabibhadana, S., Pupacdi, B., Kwon, S. M., . . . Wang, X. W. (2017). Common Molecular Subtypes Among Asian Hepatocellular Carcinoma and Cholangiocarcinoma. Cancer Cell, 32(1), 57-70.e53. doi:10.1016/j.ccell.2017.05.009
Kubo, S., Kinoshita, H., Hirohashi, K., & Hamba, H. (1995). Hepatolithiasis associated with cholangiocarcinoma. World J Surg, 19(4), 637-641.
Lazaridis, K. N., & Gores, G. J. (2005). Cholangiocarcinoma. Gastroenterology, 128(6), 1655-1667.
Sirica, A. E. (2005). Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy. Hepatology, 41(1), 5-15. doi:10.1002/hep.20537
Watanapa, P., & Watanapa, W. B. (2002). Liver fluke-associated cholangiocarcinoma. Br J Surg, 89(8), 962-970. doi:10.1046/j.1365-2168.2002.02143.x
ผลงานตีพิมพ์
2565 – Present
Khatib, S. A., Ma, L., Dang, H., Forgues, M., Chung, J. Y., Ylaya, K., . . . Wang, X. W. (2022). Single-cell biology uncovers apoptotic cell death and its spatial organization as a potential modifier of tumor diversity in HCC. Hepatology, 76(3), 599-611. doi:10.1002/hep.32345
Kheawchaum, S., Mahidol, C., Thongnest, S., Boonsombat, J., Batsomboon, P., Sitthimonchai, S., . . . Prawat, H. (2022). Ent-abietane diterpenoid lactone glycosides and a phenolic glycoside from Phlogacanthus pulcherrimus T. Anderson with cytotoxic and cancer chemopreventive activities. Phytochemistry, 201, 113261. doi:10.1016/j.phytochem.2022.113261
Bhinija, K., Huehne, P. S., Mongkolsuk, S., Sitthimonchai, S., & Satayavivad, J. (2022). A short-chain dehydrogenase/reductase (SDR) detection for the Isoflavone reductase gene in Bulbophyllum and other orchids. South African Journal of Botany, 144, 295-304. doi:https://doi.org/10.1016/j.sajb.2021.08.034
2564
Schaffer, A. A., Dominguez, D. A., Chapman, L. M., Gertz, E. M., Budhu, A., Forgues, M., . . . Wang, X. W. (2021). Integration of adeno-associated virus (AAV) into the genomes of most Thai and Mongolian liver cancer patients does not induce oncogenesis. BMC Genomics, 22(1), 814. doi:10.1186/s12864-021-08098-9
Pomyen, Y., Budhu, A., Chaisaingmongkol, J., Forgues, M., Dang, H., Ruchirawat, M., . . . Consortium, T.-L. (2021). Tumor metabolism and associated serum metabolites define prognostic subtypes of Asian hepatocellular carcinoma. Sci Rep, 11(1), 12097. doi:10.1038/s41598-021-91560-1
Hung, M. H., Lee, J. S., Ma, C., Diggs, L. P., Heinrich, S., Chang, C. W., . . . Wang, X. W. (2021). Tumor methionine metabolism drives T-cell exhaustion in hepatocellular carcinoma. Nat Commun, 12(1), 1455. doi:10.1038/s41467-021-21804-1
Moolmuang, B., & Ruchirawat, M. (2021). The antiproliferative effects of ataxia-telangiectasia mutated and ATM- and Rad3-related inhibitions and their enhancements with the cytotoxicity of DNA damaging agents in cholangiocarcinoma cells. J Pharm Pharmacol, 73(1), 40-51. doi:10.1093/jpp/rgaa050
Lertsuwan, J., Sawasdichai, A., Tasnawijitwong, N., Gaston, K., Jayaraman, P. S., & Satayavivad, J. (2021). Sequence of CX-4945 and Cisplatin Administration Determines the Effectiveness of Drug Combination and Cellular Response in Cholangiocarcinoma Cells In Vitro. Anticancer Res, 41(12), 6155-6167. doi:10.21873/anticanres.15435
2563
Kitchen, P., Lee, K. Y., Clark, D., Lau, N., Lertsuwan, J., Sawasdichai, A., . . . Jayaraman, P. S. (2020). A Runaway PRH/HHEX-Notch3-Positive Feedback Loop Drives Cholangiocarcinoma and Determines Response to CDK4/6 Inhibition. Cancer Res, 80(4), 757-770. doi:10.1158/0008-5472.CAN-19-0942
2562
Haznadar, M., Diehl, C. M., Parker, A. L., Krausz, K. W., Bowman, E. D., Rabibhadana, S., . . . Harris, C. C. (2019). Urinary Metabolites Diagnostic and Prognostic of Intrahepatic Cholangiocarcinoma. Cancer Epidemiol Biomarkers Prev, 28(10), 1704-1711. doi:10.1158/1055-9965.EPI-19-0453
Kwon, S. M., Budhu, A., Woo, H. G., Chaisaingmongkol, J., Dang, H., Forgues, M., . . . Wang, X. W. (2019). Functional Genomic Complexity Defines Intratumor Heterogeneity and Tumor Aggressiveness in Liver Cancer. Sci Rep, 9(1), 16930. doi:10.1038/s41598-019-52578-8
Weigel, C., Chaisaingmongkol, J., Assenov, Y., Kuhmann, C., Winkler, V., Santi, I., . . . Popanda, O. (2019). DNA methylation at an enhancer of the three prime repair exonuclease 2 gene (TREX2) is linked to gene expression and survival in laryngeal cancer. Clin Epigenetics, 11(1), 67. doi:10.1186/s13148-019-0666-5
Fako, V., Martin, S. P., Pomyen, Y., Budhu, A., Chaisaingmongkol, J., Franck, S., . . . Wang, X. W. (2019). Gene signature predictive of hepatocellular carcinoma patient response to transarterial chemoembolization. Int J Biol Sci, 15(12), 2654-2663. doi:10.7150/ijbs.39534
2561
Singhirunnusorn, P., Moolmuang, B., Lirdprapamongkol, K., & Ruchirawat, M. (2018). Arsenite exposure potentiates apoptosis-inducing effects of tumor necrosis factor-alpha- through reactive oxygen species. J Toxicol Sci, 43(2), 159-169. doi:10.2131/jts.43.159
Lertsuwan, J., Lertsuwan, K., Sawasdichai, A., Tasnawijitwong, N., Lee, K. Y., Kitchen, P., . . . Satayavivad, J. (2018). CX-4945 Induces Methuosis in Cholangiocarcinoma Cell Lines by a CK2-Independent Mechanism. Cancers (Basel), 10(9). doi:10.3390/cancers10090283
Lertsuwan, K., Nammultriputtar, K., Nanthawuttiphan, S., Phoaubon, S., Lertsuwan, J., Thongbunchoo, J., . . . Charoenphandhu, N. (2018). Ferrous and ferric differentially deteriorate proliferation and differentiation of osteoblast-like UMR-106 cells. Biometals, 31(5), 873-889. doi:10.1007/s10534-018-0130-6
Roeksomtawin, S., Navasumrit, P., Waraprasit, S., Parnlob, V., Sricharunrat, T., Bhudhisawasdi, V., . . . Ruchirawat, M. (2018). Decreased argininosuccinate synthetase expression in Thai patients with cholangiocarcinoma and the effects of ADI-PEG20 treatment in CCA cell lines. Oncol Lett, 16(2), 1529-1538. doi:10.3892/ol.2018.8807
2560
Chaisaingmongkol, J., Budhu, A., Dang, H., Rabibhadana, S., Pupacdi, B., Kwon, S. M., . . . Consortium, T.-L. (2017). Common Molecular Subtypes Among Asian Hepatocellular Carcinoma and Cholangiocarcinoma. Cancer Cell, 32(1), 57-70 e53. doi:10.1016/j.ccell.2017.05.009
Prachayasittikul, V., Pingaew, R., Worachartcheewan, A., Sitthimonchai, S., Nantasenamat, C., Prachayasittikul, S., . . . Prachayasittikul, V. (2017). Aromatase inhibitory activity of 1,4-naphthoquinone derivatives and QSAR study. EXCLI J, 16, 714-726. doi:10.17179/excli2017-309
2559
Moolmuang, B., Singhirunnusorn, P., & Ruchirawat, M. (2016). Effects of 5-Aza-2′-Deoxycytidine, Bromodeoxyuridine, Interferons and Hydrogen Peroxide on Cellular Senescence in Cholangiocarcinoma Cells. Asian Pac J Cancer Prev, 17(3), 957-963. doi:10.7314/apjcp.2016.17.3.957
Scarzello, A. J., Jiang, Q., Back, T., Dang, H., Hodge, D., Hanson, C., . . . Wiltrout, R. H. (2016). LTbetaR signalling preferentially accelerates oncogenic AKT-initiated liver tumours. Gut, 65(10), 1765-1775. doi:10.1136/gutjnl-2014-308810
2556
Phakeovilay, C., Disadee, W., Sahakitpichan, P., Sitthimonchai, S., Kittakoop, P., Ruchirawat, S., & Kanchanapoom, T. (2013). Phenylethanoid and flavone glycosides from Ruellia tuberosa L. J Nat Med, 67(1), 228-233. doi:10.1007/s11418-012-0658-7
Nealmongkol, P., Tangdenpaisal, K., Sitthimonchai, S., Ruchirawat, S., & Thasana, N. (2013). Cu(I)-mediated lactone formation in subcritical water: a benign synthesis of benzopyranones and urolithins A–C. Tetrahedron, 69(44), 9277-9283. https://doi.org/10.1016/j.tet.2013.08.045
2555
Disadee, W., Mahidol, C., Sahakitpichan, P., Sitthimonchai, S., Ruchirawat, S., & Kanchanapoom, T. (2012). Unprecedented furan-2-carbonyl C-glycosides and phenolic diglycosides from Scleropyrum pentandrum. Phytochemistry, 74, 115-122. doi:10.1016/j.phytochem.2011.11.001
Worawittayanon, P., Ruadreo, J., Disadee, W., Sahakitpichan, P., Sitthimonchai, S., Thasana, N., . . . Kanchanapoom, T. (2012). Iridoid and flavone glycosides from Asystasia gangetica subsp. micrantha and Asystasia salicifolia and their antioxidant activities. Biochemical Systematics and Ecology, 40, 38-42. https://doi.org/10.1016/j.bse.2011.08.016
2554
Disadee, W., Mahidol, C., Sahakitpichan, P., Sitthimonchai, S., Ruchirawat, S., & Kanchanapoom, T. (2011). Flavonol 3-O-robinobiosides and 3-O-(2″-O-α-rhamnopyranosyl)-robinobiosides from Sesuvium portulacastrum. Tetrahedron, 67(23), 4221-4226. https://doi.org/10.1016/j.tet.2011.04.041
2551
Buthbumrung, N., Mahidol, C., Navasumrit, P., Promvijit, J., Hunsonti, P., Autrup, H., & Ruchirawat, M. (2008). Oxidative DNA damage and influence of genetic polymorphisms among urban and rural schoolchildren exposed to benzene. Chem Biol Interact, 172(3), 185-194. doi:10.1016/j.cbi.2008.01.005 2550 Rangkadilok, N., Sitthimonchai, S., Worasuttayangkurn, L., Mahidol, C., Ruchirawat, M., & Satayavivad, J. (2007). Evaluation of free radical scavenging and antityrosinase activities of standardized longan fruit extract. Food Chem Toxicol, 45(2), 328-336. doi:10.1016/j.fct.2006.08.022
2547
Noonpakdee, W., Sitthimonchai, S., Panyim, S., & Lertsiri, S. (2004). Expression of the catalase gene katA in starter culture Lactobacillus plantarum TISTR850 tolerates oxidative stress and reduces lipid oxidation in fermented meat product. Int J Food Microbiol, 95(2), 127-135. doi:10.1016/j.ijfoodmicro.2004.01.020
2546
Gerhauser, C., Klimo, K., Heiss, E., Neumann, I., Gamal-Eldeen, A., Knauft, J., . . . Frank, N. (2003). Mechanism-based in vitro screening of potential cancer chemopreventive agents. Mutat Res, 523-524, 163-172. doi:10.1016/s0027-5107(02)00332-9
2542
Kengluecha, A., Noonpakdee, W. S., S. Valyasevi, R. Panyim, S. (1999). High level expression of a catalase gene from Lactobacillus sake SR911 in catalasedeficient Lactobacillus sp. TISTR891 and Lactobacillus plantarum TISTR850. Asia Pac. J. Mol. Biol. Biotechnol. , 7(2), 119-126.





